
 滬公網安備 31011502001494號
滬公網安備 31011502001494號

QC/周莉穎 2022-11-30
隨著藥品一致性評價研究工作的深入展開,我公司將面臨申報產品的注冊現場核查。為使QC檢驗人員熟悉并正確理解藥品注冊核查政策以及藥品注冊檢驗技術相關要求,加強檢驗人員技術操作規范知識點,結合日常檢驗工作中存在的不足之處,QC部于2022年11月16~11月18日進行了“標準物質管理及使用”、“實驗室OOS調查”、“分析方法的開發及轉移”、“分析方法的驗證與確認”等相關內容的網絡課程培訓,并學習了檢驗方面的常見問題、數據可靠性要求的案例分享,通過學習培訓,大家受益匪淺。
日常檢驗中,藥品標準物質是藥品檢定的重要物質基礎,是控制藥品質量必不可少的工具。QC部通過此次培訓,學習了標準物質管理的驗收、管理以及期間核查的要求。比對目前QC部對標準物質的管理現狀,發現了現階段管理中的不足之處,如:在收到標準物質時應進行運輸方式的確認,來確保標準物質在運輸過程中的貯存條件符合規定;應檢查標準物質的外觀及性狀是否符合規定,并且將其分類管理,不同用途的標準物質分開儲存。
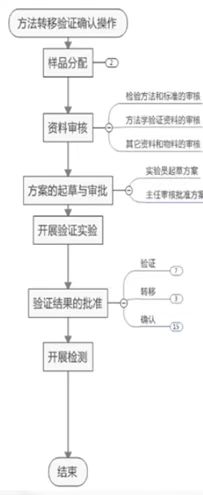
隨著藥品一致性評價的推進,QC迎接了大量的原料及成品分析方法的轉移及方法確認實驗。方法轉移程序是在兩個實驗室之間進行,通過比較轉出方和接受方實驗室的分析結果,以確認分析方法在接受方實驗室條件下的實用性。通過學習了解了方法學轉移過程中需要注意的事項和環節,相信在未來的方法轉移及方法確認的實驗過程中,QC能夠更快速高效的完成實驗。
現階段實驗室數據完整性及可靠性越來越受到重視,電子數據的審核、儀器設備的管理以及人員操作都是影響數據完整性和可靠性的因素。因此QC部在日常的檢驗中需更嚴謹、更規范地進行樣品的檢驗工作。在遇到有問題的數據結果時,不能盲目地進行重復檢驗,而需謹慎地對數據進行評估及調查。在日常的工作中,實驗人員可以通過使用標簽,多人確認復核使用的樣品、設置的方法、序列等,避免一些人為原因造成的實驗數據異常,提高檢驗效率。
通過本次培訓,QC部收益良多,相信在未來的原輔料、成品檢驗和一致性評價分析方法轉移的過程中能夠更順利地完成所有檢驗工作,提高工作效率,把控好質量關卡。

 滬公網安備 31011502001494號
滬公網安備 31011502001494號
 主站蜘蛛池模板:
恭城|
长白|
堆龙德庆县|
麻城市|
马边|
奎屯市|
兴宁市|
巴林右旗|
内乡县|
隆安县|
汨罗市|
河北区|
关岭|
沭阳县|
开远市|
东辽县|
邮箱|
托克托县|
遵化市|
大兴区|
义乌市|
苏州市|
广河县|
马关县|
金坛市|
施秉县|
鄂托克前旗|
柯坪县|
鹰潭市|
易门县|
务川|
万州区|
自贡市|
龙南县|
西华县|
五家渠市|
滨州市|
田阳县|
陇西县|
本溪市|
新乐市|
主站蜘蛛池模板:
恭城|
长白|
堆龙德庆县|
麻城市|
马边|
奎屯市|
兴宁市|
巴林右旗|
内乡县|
隆安县|
汨罗市|
河北区|
关岭|
沭阳县|
开远市|
东辽县|
邮箱|
托克托县|
遵化市|
大兴区|
义乌市|
苏州市|
广河县|
马关县|
金坛市|
施秉县|
鄂托克前旗|
柯坪县|
鹰潭市|
易门县|
务川|
万州区|
自贡市|
龙南县|
西华县|
五家渠市|
滨州市|
田阳县|
陇西县|
本溪市|
新乐市|